Foto: Archivo Siglo Nuevo
A principios de 2016 la Autoridad en Fertilización Humana y Embriología (HFEA por sus siglas en inglés) de Inglaterra aprobó la solicitud del Instituto Francis Crick para usar por primera vez en el país la edición genética en óvulos fecundados.
En septiembre pasado la doctora Kathy Niakan y su equipo del londinense Instituto Francis Crick (FCI por sus siglas en inglés) anunciaron que usaron con éxito una técnica de 'edición genética' para estudiar la función de un gen en embriones humanos.
Apenas un año antes fue autorizada para aplicar un procedimiento pionero en el ramo de la biotecnología.
La importancia del experimento realizado, según Niakan, radica en que ayuda a comprender mejor los procesos biológicos que intervienen en el desarrollo temprano del ser humano.
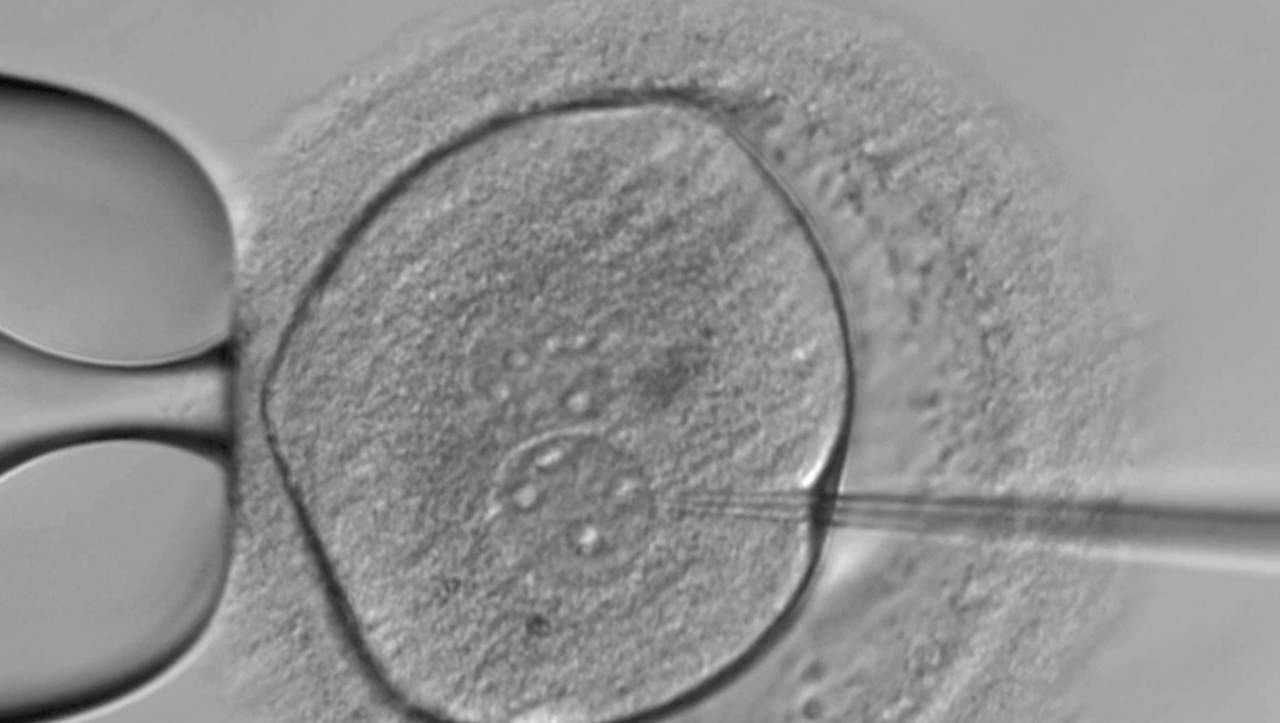
En el FCI hicieron un estudio comparativo entre dos óvulos en las primeras etapas posteriores a su fecundación. Uno había sido 'editado' para que no se produjera un contenido proteínico determinado, el otro se mantuvo inalterado. En éste segundo caso, se formó una estructura celular compleja, el blastocito; en el óvulo intervenido no se observaron cambios.
Una manera de saber cómo contribuyen los genes al crecimiento del embrión, afirman los investigadores universitarios, es ver qué pasa cuando no están trabajando.
La doctora Niakan celebró que “Ahora tenemos una forma eficiente de hacerlo. Esperamos que otros científicos la utilicen para encontrar las funciones de otros genes”.
Si se descubren las claves para un desarrollo exitoso del nuevo ser, indicó la experta en biología celular y molecular, podremos desarrollar mejores tratamientos de fertilidad y comprender algunas causas de los embarazos fallidos.
BREVE HISTORIA
En el Francis Crick utilizaron la técnica denominada CRISPR. En ella se toma un fragmento de ARN que tiene una doble función: por un lado, permite apuntar hacia el trozo de código genético que se quiere modificar y se une a él; por el otro, recluta a una molécula cuya función es cortar el ADN. Esto sirve al propósito de eliminar secuencias indeseables.
La ingeniería genética es una rama que comenzó en la década de los setenta del siglo pasado, con el estadounidense Paul Berg aislando un fragmento de ácido desoxirribonucleico de un virus que infecta bacterias para después unirlo al código de un virus de mono.
Hacia finales de esa década ya era habitual el uso de ratones transgénicos en la investigación de enfermedades.
Sin embargo, los métodos de aquella época, como acostumbran ser los primeros pasos, eran inexactos y su aplicación a gran escala entrañaba una complejidad mayúscula.
En los noventa se diseñaron proteínas para cortar en zonas específicas al portador de la información hereditaria y dejar de poner en manos de la suerte la aparición de una mutación útil. Sin embargo, debía elaborarse una proteína específica para cada secuencia a intervenir.
El siguiente paso adelante se dio en las universidades de Umeå y de California en Berkeley: descubrieron un método que permitía modificar material genético con rapidez y con mínimos recursos. Luego, especialistas de Harvard y del Instituto de Tecnología de Massachusetts demostraron que el procedimiento podía detonar muchos cambios en el genoma con precisión y una coordinación adecuada.
En julio de este año se informó que un equipo internacional ejecutó con éxito la CRISPR en embriones humanos. Los investigadores confían en que un día cercano será posible corregir defectos congénitos antes del nacimiento sin introducir errores adicionales.

Niakan utilizó la técnica de edición de genes CRISPR para descubrir cómo un gen afecta el crecimiento de embriones humanos. Foto: Instituto Francis Crick
Cuando se habla de errores de edición a nivel genético es porque el proceso de cortado y pegado da lugar a mosaicismo: variaciones genéticas no deseadas y potencialmente peligrosas. Una pregunta enciende la desconfianza de buena parte de la comunidad científica: ¿cómo evitar esos resultados inesperados y dañinos?
Otro aspecto sujeto a discusión llama la atención sobre modificar la línea base del organismo: las variantes introducidas serían transmitidas de generación en generación con la alteración que esto representa.
En febrero de este año un panel de expertos reunido por la Academia Nacional de Ciencias estadounidense concluyó que aplicar las tijeras proteínicas en embriones humanos es aceptable siempre que sea el 'último recurso'.
POLÉMICA Y BOLSA
A principios de 2016 la Autoridad en Fertilización Humana y Embriología (HFEA por sus siglas en inglés) de Inglaterra aprobó la solicitud del Instituto Francis Crick para usar por primera vez en el país la edición genética en óvulos fecundados.
Los experimentadores contaban con 54 ejemplares sobrantes de tratamientos de fecundación in vitro.
Entre los detractores del experimento se maneja que, desde el punto de vista ético, estas experiencias son inaceptables.
En terrenos menos dados a la polémica, Estados Unidos aprobó ensayos clínicos para emplear la técnica en el estudio de tres tipos de cáncer. En China se dispuso autorizar el uso de este logro de la biotecnología en casos avanzados de cáncer de pulmón.
Ya en materia de negocios genéticos, a principios del año pasado, una startup llamada Editas Medicine, respaldada por Google Ventures y Bill Gates, entre otros, se convirtió en la primera empresa dedicada a la edición de código biológico en cotizar en la bolsa.
La presentación de EM dice que “ha construido una plataforma que utiliza CRISPR, un enfoque potencialmente revolucionario”. Recientes avances, expone la compañía, han hecho posible alterar casi cualquier gen de las células humanas.
Un estudio de The Boston Consulting Group encontró que en los dos años previos al inicio de las operaciones bursátiles de Editas se habían invertido más de 1 mil millones de dólares en compañías relacionadas con genes editados.
La expectación que causa el polémico procedimiento se debe, efectivamente, a su potencial para cambiar de forma radical la vida en el planeta. Una utilidad elemental se ubicaría en la agricultura con el diseño de cultivos resistentes a las pestes.
En el campo de la salud se podría 'corregir la información' que ocasiona enfermedades hereditarias y males que afectan a millones de personas.
Sin embargo, existe el temor de que alguien se tome en serio la posibilidad de crear seres 'perfectos' con capacidades físicas y mentales superiores, mejorar a la población eliminando características 'no deseables' como un color de piel, o una estatura o complexión determinadas.
DEBATE
El debate ético sobre las consecuencias de alterar el genoma humano y que esos cambios sean heredados a las futuras generaciones motivó la imposición de límites por parte de la HFEA.
El organismo prohibió usar CRISPR-Cas9 para cuestiones reproductivas en tanto no se cumplan un par de condiciones: una es implementar mejores mecanismos de inspección y rendición de cuentas de los experimentos, y la segunda consiste en demostrar que las posibilidades de cometer errores son mínimas.
No obstante, la HFEA reconoce que las pruebas con embriones pueden ayudar a la gente con males hereditarios muy serios y evitar su transferencia a la siguiente generación. En esos casos la aplicación de la técnica estaría permitida.
La comunidad científica también admite la terapia génica, es decir, alterar los genes de alguien que ya está enfermo. No es preocupante en el sentido de que no implica heredar los cambios al código base.
En el debate ético, así como en las decisiones adoptadas por los organismos, no sólo influye el potencial de la biotecnología para revolucionar campos como el sector agrícola. También influye el hecho de que investigaciones como la realizada por Kathy Niakan no habrían sido posibles sin el apoyo de personas que, con la esperanza de hallar un tratamiento para un problema de fertilidad en apariencia irresoluble, donaron sus células embrionarias.